11月26日,國際學術期刊 Nature Aging在線發表了中國科學院上海營養與健康研究所肖意傳研究組的合作研究成果,題目為”Age-related decline in CD8+?tissue resident memory T cells compromises antitumor immunity”。肖意傳團隊長期致力于免疫衰老與腫瘤免疫的調控機制探究,此研究發現衰老會導致腫瘤微環境中組織駐留CD8+?T細胞(Tissue Resident Memory, TRM)浸潤明顯減少,而這類細胞亞群被認為是一類具有高度抗腫瘤效應的CD8+?T細胞,這可能是衰老導致CD8+?T細胞功能障礙的關鍵機制。
人口老齡化已成為全球普遍現象,衰老相關疾病的防治已成為亟待解決的關鍵社會問題。伴隨著衰老過程,人類患癌癥的風險顯著上升,據統計約有2/3的新發腫瘤患者的年齡大于65歲,衰老已成為腫瘤高發的關鍵因素。目前普遍接受的觀點是個體衰老進程會導致DNA損傷和原癌基因的激活,進而會誘導細胞發生癌前病變。除此以外,越來越多的報道指出,免疫衰老是衰老個體共有的生理現象,它是伴隨著年齡增長出現的免疫系統的退行性改變,是導致個體“免疫力”下降,進而誘發包括腫瘤等在內的疾病的關鍵原因。其中,T細胞是機體重要的免疫細胞之一,尤其是CD8+?T細胞作為抗腫瘤免疫的一線細胞,識別抗原后能直接對腫瘤細胞進行殺傷,在腫瘤免疫治療中發揮了重要的調控作用。但是,衰老是如何影響CD8+?T細胞的功能及其介導的抗腫瘤效應的,機制尚不明確。
首先,為了研究衰老個體來源CD8+?T細胞的內在調控機制,研究人員分別分選了年輕和衰老個體來源的CD8+T細胞過繼轉移到Rag1-/-小鼠體內并誘導皮下腫瘤,對腫瘤浸潤的CD8+T細胞進行單細胞測序分析發現,衰老組的TRM細胞浸潤明顯減少,于是研究人員猜測衰老個體來源的CD8+ T細胞其向TRM細胞分化的能力受到抑制,并通過體外分化實驗驗證了這一猜想。
為了進一步探究衰老導致TRM分化受到抑制的分子機制,通過多因素基因篩選發現,在老年個體來源CD8+?T細胞中,E3泛素連接酶BFAR的高表達會抑制TRM細胞的產生;在機制方面,E3泛素連接酶BFAR可通過直接介導去泛素化酶USP39的泛素化并使其活化,進而促進USP39對JAK2的去泛素化,從而抑制了細胞因子誘導的JAK-STAT信號通路的激活,最終導致TRM的分化的降低及其介導的機體抗腫瘤免疫反應的缺陷。特異性在CD8+?T細胞中敲除BFAR基因則顯著促進了其在腫瘤微環境中向TRM的分化,進而增強了其抗腫瘤的免疫功能。
鑒于BFAR的這一功能,研究人員利用高通量藥物篩選平臺結合體外細胞功能實驗分析,篩選獲得了特異性靶向BFAR的小分子抑制劑iBFAR2,通過體外和體內實驗都證明該小分子抑制劑可以模擬BFAR敲除的表型,即可顯著促進CD8+?T細胞在腫瘤微環境中向TRM的分化,由此增強了CD8+?T細胞的抗腫瘤免疫功能,因此其可有效恢復老年個體來源的CD8+?T細胞的抗腫瘤免疫功能。
靶向PD-1/PD-L1免疫檢查點阻斷介導的免疫治療,已成為晚期腫瘤治療的新趨勢,但是其受益腫瘤患者有限,有相當一部分晚期患者對此種療法并不敏感。已有研究發現,T細胞衰老和PD-1/PD-L1抗體介導的腫瘤免疫治療效果不佳有關。研究團隊的結果也發現,利用篩選獲得的BFAR小分子抑制劑iBFAR2可明顯增加PD-1抗體介導的免疫治療敏感性,且降低了利用高劑量PD-1抗體引起的系統性炎癥的副作用。此外,iBFAR2還能有效抑制PD-1抗體不響應腫瘤的生長。因此,靶向BFAR不僅可以促進老年個體的抗腫瘤免疫應答,還可增敏PD-1抗體的腫瘤免疫治療效果,并為臨床PD-1抗體不響應患者的腫瘤免疫治療提供新的策略。
綜上所述,本研究揭示了衰老影響機體CD8+?T細胞抗腫瘤免疫反應的作用和分子機理,對衰老個體和PD-1抗體治療不響應患者的腫瘤免疫防御能力缺陷的機制探究,進行了重要的補充。BFAR作為衰老調控的關鍵靶點,提示其對于臨床老年患者腫瘤免疫治療具有重要意義。
中國科學院上海營養與健康研究所副研究員裴思雨,博士生鄧修瑜,中國科學院上海藥物研究所楊瑞瑞,上海市胸科醫院副研究員王慧和河北大學附屬醫院研究員史建紅為該論文的第一作者。中國科學院上海營養與健康研究所肖意傳研究員,中國科學院上海藥物研究所鄭明月研究員,上海市胸科醫院羅清泉主任醫師和河北工程大學倪志宇教授為論文的共同通訊作者。該工作得到了科技部、國家自然科學基金委和中國科學院的資助,同時也得到了中國科學院上海營養與健康研究所公共技術中心分析測試技術平臺和實驗動物技術平臺的支持。
原文鏈接:https://www.nature.com/articles/s43587-024-00746-5
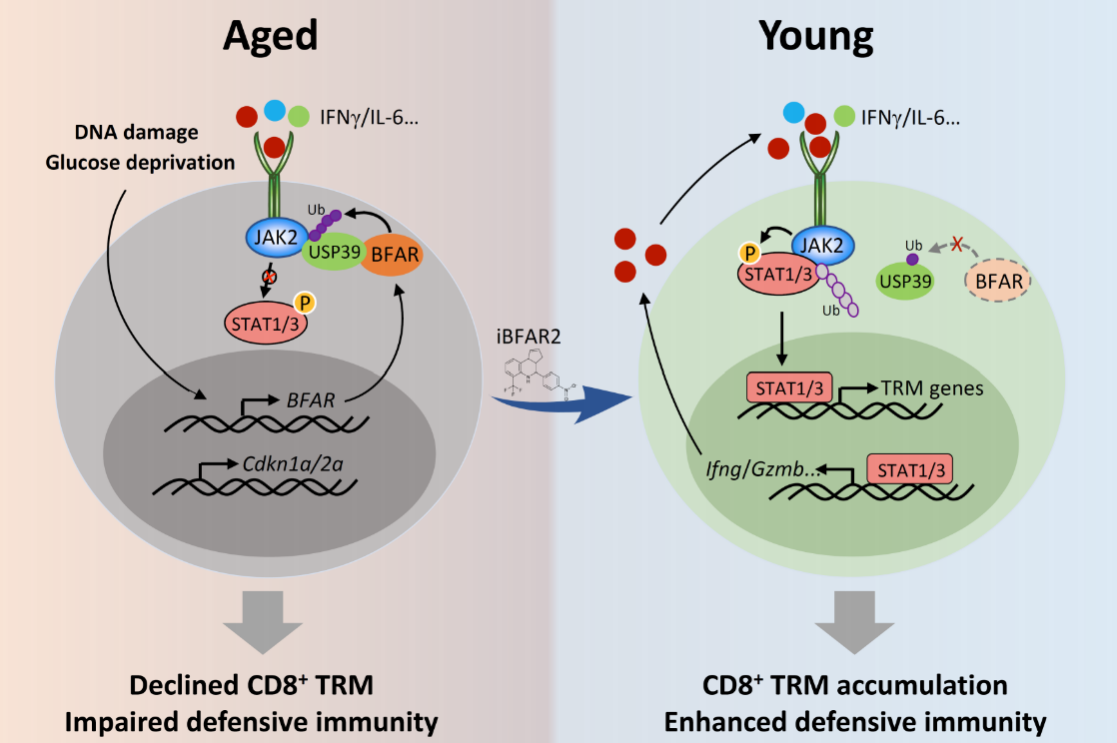
衰老抑制CD8+?T細胞介導的抗腫瘤免疫模式圖